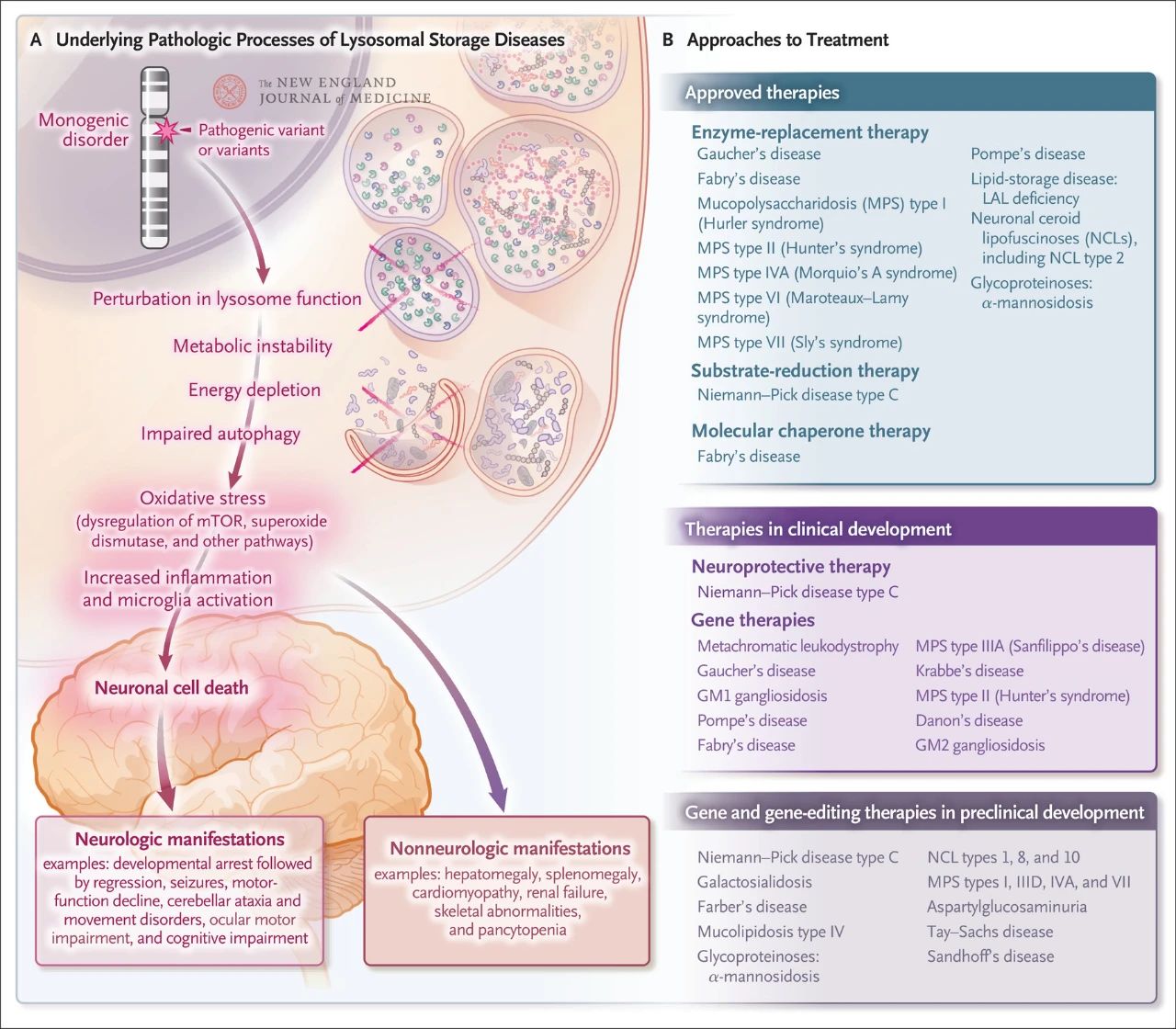
Хотя лизосомные болезни накопления встречаются относительно редко, общая частота их составляет примерно 1 на 5000 живорождений. Кроме того, из почти 70 известных лизосомных болезней накопления 70% поражают центральную нервную систему. Эти моногенные нарушения вызывают лизосомную дисфункцию, что приводит к метаболической нестабильности, нарушению регуляции белка-мишени рапамицина у млекопитающих (mTOR, который в норме подавляет воспаление), нарушению аутофагии и гибели нервных клеток. Несколько методов лечения, направленных на основные патологические механизмы лизосомных болезней накопления, уже одобрены или находятся в стадии разработки, включая ферментозаместительную терапию, субстратредуктивную терапию, терапию молекулярными шаперонами, генную терапию, редактирование генов и нейропротекторную терапию.
Болезнь Ниманна-Пика типа C представляет собой лизосомальное нарушение клеточного транспорта холестерина, вызванное биаллельными мутациями в гене NPC1 (95%) или NPC2 (5%). Симптомы болезни Ниманна-Пика типа C включают быстрое фатальное ухудшение неврологических функций в младенчестве, тогда как поздние ювенильные, ювенильные и взрослые формы включают спленомегалию, надъядерный паралич взора и мозжечковую атаксию, дизартикуляцию и прогрессирующую деменцию.
В этом выпуске журнала Бремова-Эртл и соавторы публикуют результаты двойного слепого плацебо-контролируемого перекрёстного исследования. В исследовании использовался потенциальный нейропротектор, аналог аминокислоты N-ацетил-L-лейцин (NALL), для лечения болезни Ниманна-Пика типа C. В исследовании приняли участие 60 пациентов подросткового и взрослого возраста с симптомами. Результаты показали значительное улучшение общего балла (первичной конечной точки) по шкале оценки и оценки атаксии.
Клинические испытания N-ацетил-DL-лейцина (Танганила), рацемического препарата NALL и n-ацетил-D-лейцина, по-видимому, в значительной степени обусловлены опытом: механизм действия до сих пор не до конца изучен. N-ацетил-DL-лейцин одобрен для лечения острого головокружения с 1950-х годов; исследования на животных показывают, что препарат действует, восстанавливая баланс гиперполяризации и деполяризации медиальных вестибулярных нейронов. Впоследствии Штрупп и соавторы опубликовали результаты краткосрочного исследования, в котором наблюдалось улучшение симптомов у 13 пациентов с дегенеративной мозжечковой атаксией различной этиологии. Эти результаты вновь пробудили интерес к этому препарату.
Механизм, посредством которого n-ацетил-DL-лейцин улучшает нервную функцию, пока не ясен, но результаты, полученные на двух моделях мышей, одной с болезнью Ниманна-Пика типа C, а другой с болезнью накопления ганглиозидов GM2 варианта O (болезнь Сандхоффа), другим нейродегенеративным лизосомным заболеванием, побудили внимание обратить на NALL. В частности, выживаемость мышей Npc1-/-, получавших n-ацетил-DL-лейцин или NALL (L-энантиомеры), улучшилась, в то время как выживаемость мышей, получавших n-ацетил-D-лейцин (D-энантиомеры), не изменилась, что позволяет предположить, что NALL является активной формой препарата. В аналогичном исследовании болезни накопления ганглиозидов GM2 варианта O (Hexb-/-), n-ацетил-DL-лейцин привел к умеренному, но значимому продлению жизни у мышей.
Чтобы изучить механизм действия n-ацетил-DL-лейцина, исследователи изучили метаболический путь лейцина, измеряя метаболиты в тканях мозжечка мутантных животных. В модели варианта O болезни накопления ганглиозидов GM2 n-ацетил-DL-лейцин нормализует метаболизм глюкозы и глутамата, усиливает аутофагию и повышает уровень супероксиддисмутазы (активного поглотителя кислорода). В модели C болезни Ниманна-Пика наблюдались изменения метаболизма глюкозы и антиоксидантов, а также улучшение митохондриального энергетического обмена. Хотя L-лейцин является мощным активатором mTOR, не наблюдалось никаких изменений уровня или фосфорилирования mTOR после лечения n-ацетил-DL-лейцином или его энантиомерами ни в одной из моделей мышей.
Нейропротекторный эффект NALL наблюдался на мышиной модели повреждения мозга, вызванного кортикальным импинджментом. Эти эффекты включают снижение уровня нейровоспалительных маркеров, уменьшение гибели корковых клеток и улучшение аутофагического потока. После лечения NALL двигательные и когнитивные функции пострадавших мышей восстановились, а размер поражения уменьшился.
Воспалительная реакция центральной нервной системы является отличительной чертой большинства нейродегенеративных лизосомных болезней накопления. Если нейровоспаление удастся уменьшить с помощью лечения NALL, клинические симптомы многих, если не всех, нейродегенеративных лизосомных болезней накопления могут быть улучшены. Как показывает данное исследование, NALL также, как ожидается, будет обладать синергизмом с другими методами лечения лизосомных болезней накопления.
Многие лизосомные болезни накопления также связаны с мозжечковой атаксией. Согласно международному исследованию с участием детей и взрослых с болезнями накопления ганглиозидов GM2 (болезнь Тея-Сакса и болезнь Сандхоффа), атаксия уменьшилась, а мелкая моторная координация улучшилась после лечения NALL. Однако крупное многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование показало, что n-ацетил-DL-лейцин не был клинически эффективен у пациентов со смешанной (врожденной, ненаследственной и необъяснимой) мозжечковой атаксией. Это открытие предполагает, что эффективность может наблюдаться только в исследованиях с участием пациентов с наследственной мозжечковой атаксией и анализом связанных с ней механизмов действия. Кроме того, поскольку NALL уменьшает нейровоспаление, которое может привести к черепно-мозговой травме, могут быть рассмотрены исследования NALL для лечения черепно-мозговой травмы.
Время публикации: 02 марта 2024 г.