Кахексия — системное заболевание, характеризующееся потерей веса, атрофией мышечной и жировой ткани и системным воспалением. Кахексия — одно из основных осложнений и причин смерти онкологических больных. Помимо рака, кахексия может быть вызвана различными хроническими доброкачественными заболеваниями, включая сердечную недостаточность, почечную недостаточность, хроническую обструктивную болезнь легких, неврологические заболевания, СПИД и ревматоидный артрит. По оценкам, частота кахексии у онкологических больных может достигать 25–70%, что серьёзно влияет на качество жизни пациентов и усугубляет токсические эффекты лечения.
Эффективное лечение кахексии имеет большое значение для улучшения качества жизни и прогноза онкологических больных. Однако, несмотря на определённый прогресс в изучении патофизиологических механизмов кахексии, многие препараты, разработанные на основе возможных механизмов, эффективны лишь частично или неэффективны. В настоящее время не существует эффективного метода лечения, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Существует множество причин неудач клинических испытаний кахексии, и основная из них может заключаться в недостаточном понимании механизма и естественного течения кахексии. Недавно профессор Сяо Жуйпин и исследователь Ху Синьли из Колледжа технологий будущего Пекинского университета опубликовали совместную статью в журнале Nature Metabolism, в которой раскрывается важная роль пути lactic-GPR81 в возникновении раковой кахексии, что предлагает новую концепцию лечения кахексии. Мы обобщаем эти данные, обобщая статьи из журналов Nat Metab, Science, Nat Rev Clin Oncol и других.
Потеря веса обычно вызвана снижением потребления пищи и/или увеличением расхода энергии. Предыдущие исследования показали, что эти физиологические изменения при опухолевой кахексии обусловлены определенными цитокинами, секретируемыми микроокружением опухоли. Например, такие факторы, как фактор дифференцировки роста 15 (GDF15), липокалин-2 и инсулиноподобный белок 3 (INSL3), могут подавлять потребление пищи, связываясь с регуляторными участками аппетита в центральной нервной системе, что приводит к анорексии у пациентов. ИЛ-6, ПТГрП, активин А и другие факторы способствуют потере веса и атрофии тканей, активируя катаболический путь и увеличивая расход энергии. В настоящее время исследования механизмов кахексии в основном сосредоточены на этих секретируемых белках, и лишь немногие исследования посвящены связи между метаболитами опухоли и кахексией. Профессор Сяо Жуйпин и исследователь Ху Синьли разработали новый подход к раскрытию важного механизма опухолевой кахексии с точки зрения метаболитов опухоли.
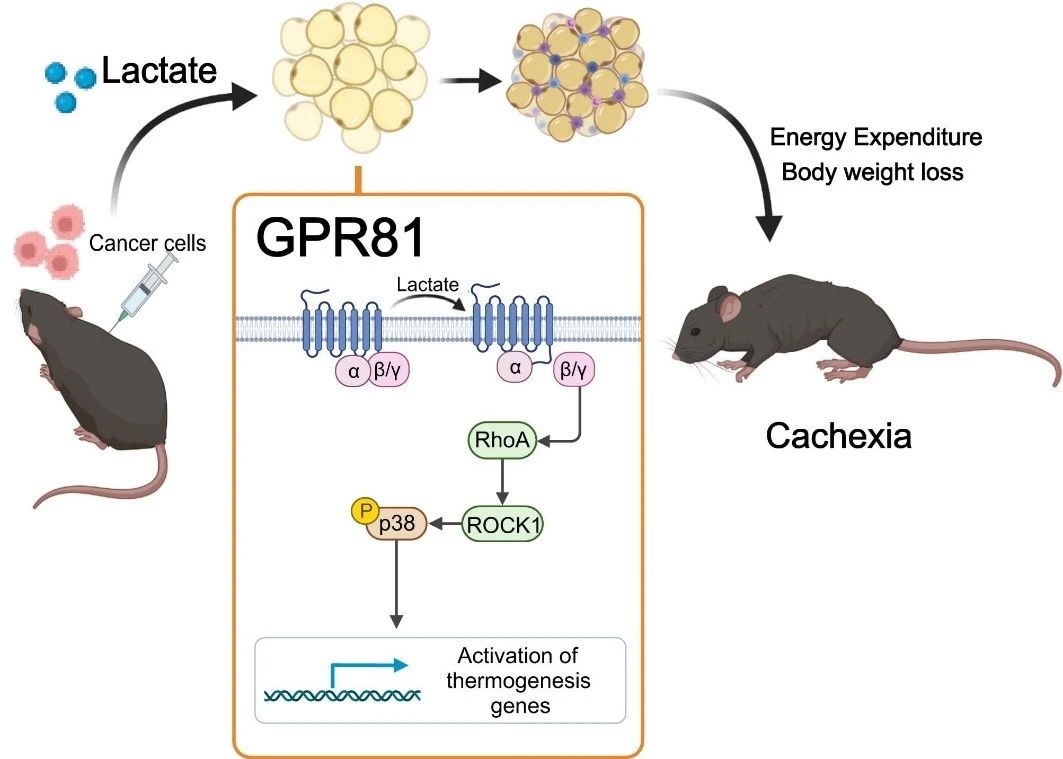
Во-первых, команда профессора Сяо Жуйпина провела скрининг тысяч метаболитов в крови здоровых контрольных животных и мышей с моделью кахексии при раке лёгких и обнаружила, что молочная кислота была наиболее выраженным метаболитом у мышей с кахексией. Уровень молочной кислоты в сыворотке увеличивался по мере роста опухоли и демонстрировал сильную корреляцию с изменением веса мышей с опухолью. Образцы сыворотки, полученные от пациентов с раком лёгких, подтверждают, что молочная кислота также играет ключевую роль в прогрессировании кахексии при раке лёгких.
Чтобы определить, вызывает ли высокий уровень молочной кислоты кахексию, исследовательская группа вводила молочную кислоту в кровь здоровых мышей через осмотический насос, имплантированный под кожу, искусственно повышая уровень молочной кислоты в сыворотке до уровня, характерного для мышей с кахексией. Через 2 недели у мышей развился типичный фенотип кахексии, такой как потеря веса, атрофия жировой и мышечной ткани. Эти результаты свидетельствуют о том, что ремоделирование жировой ткани, вызванное лактатом, аналогично ремоделированию, вызываемому раковыми клетками. Лактат является не только характерным метаболитом раковой кахексии, но и ключевым медиатором гиперкатаболического фенотипа, вызванного раком.
Далее они обнаружили, что делеция рецептора лактата GPR81 эффективно облегчала проявления кахексии, вызванной опухолью и сывороточным лактатом, не влияя на уровень лактата в сыворотке. Поскольку GPR81 высоко экспрессируется в жировой ткани и изменения в жировой ткани происходят раньше, чем в скелетных мышцах при развитии кахексии, специфический эффект нокаута GPR81 в жировой ткани мышей аналогичен эффекту системного нокаута, улучшая вызванное опухолью снижение веса и расход жира и скелетных мышц. Это позволяет предположить, что GPR81 в жировой ткани необходим для развития раковой кахексии, вызванной молочной кислотой.
Дальнейшие исследования подтвердили, что после связывания с GPR81 молекулы молочной кислоты вызывают жировое потемнение, липолиз и повышенную системную выработку тепла через сигнальный путь Gβγ-RhoA/ROCK1-p38, а не классический путь PKA.
Несмотря на многообещающие результаты в исследовании патогенеза кахексии, связанной с раком, эти данные пока не нашли широкого применения в эффективных методах лечения, поэтому в настоящее время отсутствуют стандарты лечения для таких пациентов. Однако некоторые общества, такие как ESMO и Европейское общество клинического питания и метаболизма, разработали клинические рекомендации. В настоящее время международные рекомендации настоятельно рекомендуют стимулировать метаболизм и снижать катаболизм с помощью таких подходов, как питание, физические упражнения и лекарственная терапия.
Время публикации: 28 апреля 2024 г.